リチウムイオン二次電池(Lithium ion battery)
通信添削 Z会 の添削問題にとても解りやすい説明がありましたので、それを参考にして説明します。
1.リチウムイオン電池とは
1.導入
1990年代までの二次電池の主流はニッケルカドミウム電池でした。そして、ハイブリッド車の駆動電池であるニッケル水素電池は、日本の企業が世界に先駆けて量産化した。
しかし、ニッケル水素電池が普及した数年後にはリチウムイオン電池の時代が始まった。
リチウムイオン二次電池(LIB)は日本で完成され、日本の企業が初めて量産化したもので、現在、携帯電話、スマートフォン、ノートパソコン、ハイブリッド車、電気自動車、等々・・・に幅広く使われている。
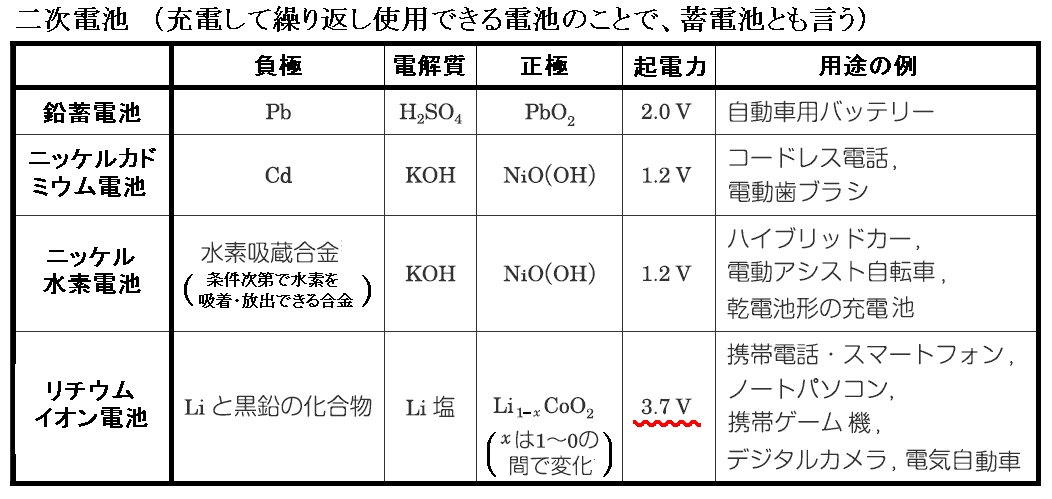
電解質の欄ですが、リチウムイオン電池以外は水溶液を用いるため原理的に1.5V前後という水の電気分解電圧以下の起電力しか取り出せないが、非水溶媒を用いるリチウムイオン電池は3V以上の高起電力が可能です。
“リチウムイオン二次電池”は、今日とても重要な電池ですが、その実体を理解するのは難しい。負極に金属リチウムを用いる“リチウム一次電池”との違いも良く解らない所です。
以下で、リチウムイオン電池の本質を解りやすく説明します。
2.リチウムイオン二次電池
ここでは、1991年代始めに実用化されたリチウムイオン電池を例にして説明します。
それは充電状態で
正極――コバルトⅢリチウムLi0.5CoO2 (例として組成比が、Li:Co:O=0.5:1:2 の場合を示す)
負極――Liイオンを取り込んだLiC6の組成物質
の状態の電池です。
この電池の放電反応は下記の様になります。
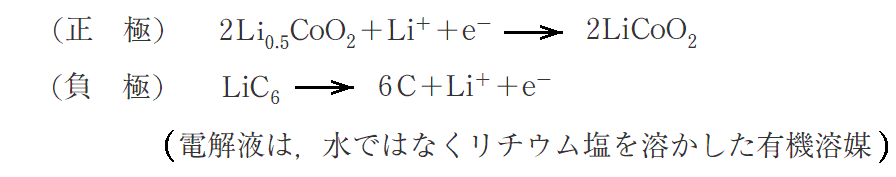
水溶液を用いる電池では1.5V前後という水の電気分解電圧以下の起電力しか取り出せないが、リチウムイオン電池は非水溶媒を用いるために3V以上の高起電力化が可能で、その意味でも高エネルギー密度を可能にする。

ちなみに、電解液は環状炭酸エステルと鎖状炭酸エステルの混合溶媒に LiPF6 や LiBF4 などの電解質塩を溶解させたものが用いられる。
電池全体の反応は以下の通りです。
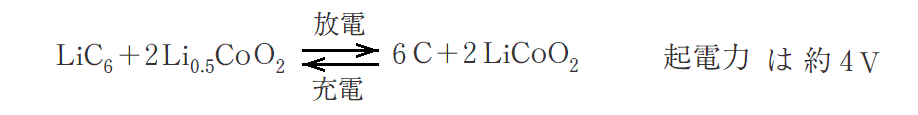
固体には隙間の多い結晶構造を持つもの(酸化コバルト CoO2)があります。そのような固体が正極となって、放電時に電子e-を受け取ったとき電子と同数の1価陽イオンLi+が隙間に入り込みます。
もう一方の負極(黒鉛 C6)にも隙間があって、隙間に入り込んでいた同じ原子Li(下図参照)
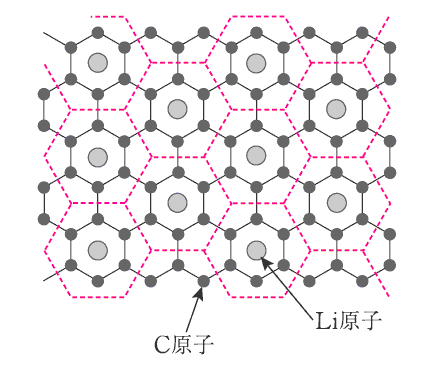
が陽イオンと電子となって出て行く。そのとき放出された電子が外部回路を流れて電流を形成する。
3.リチウムイオン電池の特徴
- 同じ陽イオンが正極と負極を行き来するだけです。。充電や放電において、Li+は正極と負極にある隙間を出入りするだけで、電極内物質の酸化数が変化する電池です。これは、この電池の最大の特徴であり、この電池名(リチウムイオン二次電池)の由来でもある。
- 電極を構成する物質には酸化数以外の変化はない。用いるLi+の量もその変化を実現するための最小限の量だけ存在すれば良い。原理的に科学的変化を伴わない(イオンと電子のみが関与する)電池反応なので、副反応による劣化が少なくサイクル耐久性、長期保存安定性に優れている。
- 充電時にLi+は黒鉛Cの格子内で電子e-を受け取ってLiに還元されるが、Li原子は互いに離れた状態にとどまっているため、多くの原子が集合したLiの金属は生じにくい。そのためショートや劣化の原因となる樹枝状の結晶(デンドライト)ができない。そのため電池の安定性・耐久性が良い。
“リチウムイオン二次電池”とは、リチウムイオンを吸蔵・離脱し得る炭素質材料を《負極活物質〉とし、リチウムイオン吸蔵・離脱し得るリチウムイオン含有金属酸化物(LiCoO2)を〈正極活物質〉として用いたトポ化学反応原理(化学的な反応を伴わず、ホスト分子等にゲスト分子・ゲストイオン等が出入りする現象)に基づく非水系二次電池の事です。
充電によりがLiCoO2に含有されているリチュウムイオンが脱離し、負極の炭素質材料に吸蔵される。逆に放電では負極に吸蔵されていたリチウムイオンが脱離し、正極に再び戻っていく。この反応のくりかえしにより充放電が行われる。[文献3.より引用]
このような反応系で リチウムイオンが、正極の酸化コバルトと、そして負極の黒鉛類似の炭素質材料と、その様に微妙な結合状態・相互作用状態になれて電池を構成できると言う所が最大の発見です。
実際、リチウムイオンがその様な可能性を秘めていることはなかなか思い至れないことですから、 大発見!! と言って良い。
以下は文献4.より引用[拡大版はこちら]

4.リチウムイオン電池とノーベル賞
1970年代の中頃、当時エクソンに勤務していたスタンリー・ウィッティンガムが、非常に軽くて反応性の高い金属である《リチウム》を負極材として使う手法を発見した。これは素晴らしい発見だった。リチウムは電子を放出しやすいだけでなく、リチウムイオンは電子をチャージすることもできた。
しかし残念ながら、この新しい電池は破裂しやすいという弱点を抱えていた。
その弱点の解消につながったのが、オックスフォード大学に勤務していたジョン・グッドイナフの発見だった。
彼は1980年に研究チーム(留学生だった東芝エグゼクティブフェローの水島公一も在籍していた)とともに、《酸化コバルト》を“正極材”として使うことで、従来よりもはるかに安定した電池をつくれることを発見した。
吉野氏も.述べている様に、これがリチウムイオンを含有した正極材料である事が電池を構成する上で本質的に重要であった。
さらに、同じ1980年代に吉野彰の研究チームは、複雑な《黒鉛ベースの物質》を“負極材”とすることで、リチウムイオンを内部に閉じ込めることで電流を流す方法を発見した。
吉野は様々な文献で、この発見は、福井謙一のフロンティア電子論や白川英樹が発見した電気を流せるプラスチック(ポリアセチレン)などの先行研究に助けられたと語っている。ここはこの負極材の本質にかかわるところで、文献3.の吉野氏ご本人の説明をご覧下さい。
吉野はさらに、古い型の電池とは違って発火しない(少なくとも、古い型の電池ほど簡単には発火しない)ことを実現する様々な技術的な方法も開発した。
リチウムイオン電池の発明・開発の業績により、上記3名が2019年度ノーベル化学賞を受賞した。
2.反応の実際
1.モル当たりの充電量の見積
放電後のリチウムイオン電池を充電するとき、例えば次のイオン反応式が正極で生じたとする。
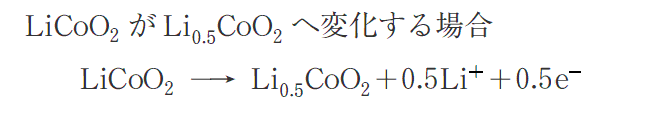
このとき、正極で起こる変化は電気分解の陽極で起こる酸化反応に相当する。つまりLiCoO2の1molからLi+が0.5mol引き抜かれるときに、一部のCo原子が0.5mol酸化され、残りのCo原子は酸化されていない。
このとき、酸化された0.5molのCo原子は、酸化の前後で酸化数が+3から+4に変化している。つまり

となる。
例えば充電反応が95%の効率で進行したと仮定すると、この反応のLiCoO21molの充電に必要な電気量は
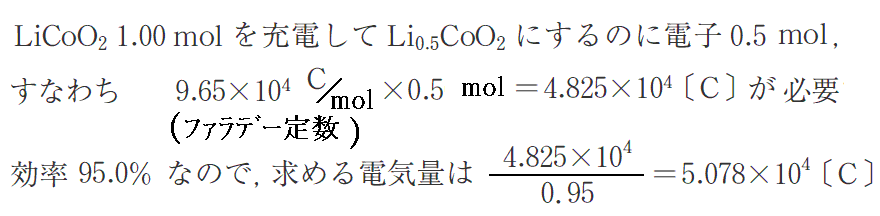
となる。
2.電極質量の変化と移動電気量
放電時に負極の質量がMg減少したとする。放電の電流効率が100%と見なせる場合、この放電によって流れた電気量は何Cになるか求めて見る。
負極では次のような反応が起こる。
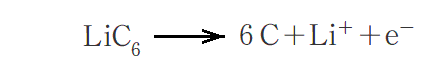
放電時に負極の質量がMg減少したことと、Liの原子量=6.94g/molより
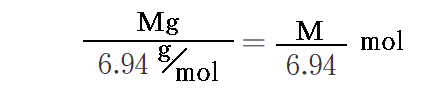
のリチウム原子が反応したことになる。故に流れた電気量は
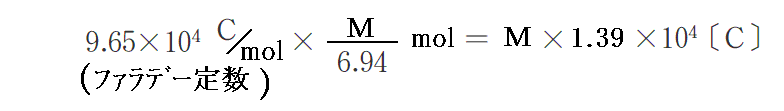
となる。このように炭素約6個に1個の正イオンのドーピングが可能です。このことの意味は文献3.をご覧下さい。
リチウムイオン電池は重量エネルギー密度も体積エネルギー密度も高い電池です。そのため同じエネルギーを蓄えた電池として他の形式の電池よりも小さく軽くできます。
また、得られる電圧も高いので、直列接続で同じ電圧を出すとすれば使用本数が少なくて済みますし、蓄えられるエネルギー密度も大きくなります。これは非水溶媒を使う事ができるこの電池の大きな特徴であり、優れた点でもあります。
3.Li原子の原子間距離
リチウムイオン電池の負極の組成式LiC6であるが、実際、黒鉛の6個のC原子当たり1個のLi原子が取り込まれていることが解っている。
C原子が平面網目状に結合した正六角形であり、この中心にLi原子が取り込まれているとして、Li原子間距離(中心距離)を求めて見る。
LiC6の組成式より炭素とリチウムの組成比は 6:1 であるから、下図で示す赤破線で示す正六角形の繰り返し単位の中に、Li原子が1個ずつ含まれている。
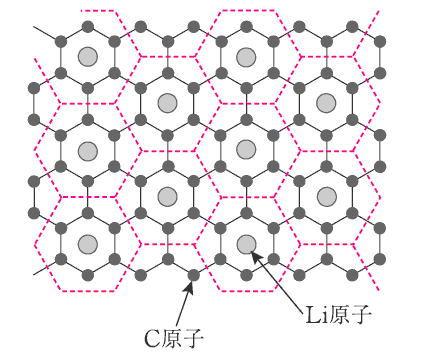
上図の一部を取り出したものが下図です。
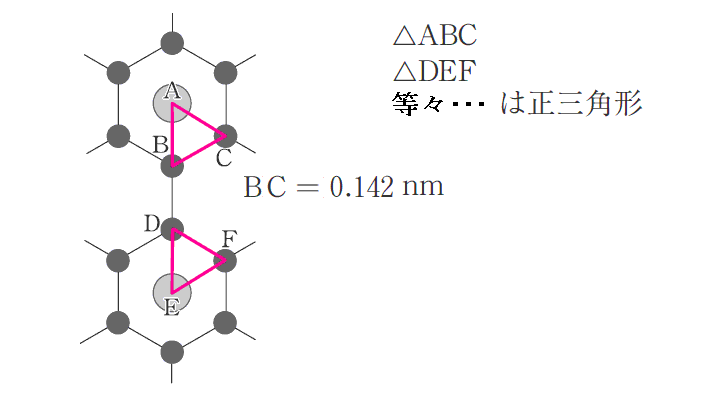
図から明らかな様に、最も近いLに原子間距離は、黒鉛平面の最も近いC原子間の距離の3倍ですから
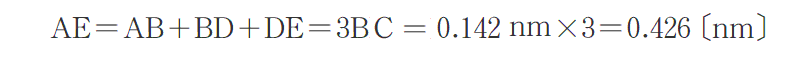
となる。
この性質の為に、リチウムイオン電池はデンドライトが生じにくく、充電時のメモリー効果(充放電を繰り返すと充電容量が減ってくる事)も生じにくい優れた特性を持つ。
4.実際の電極反応
酸化コバルトCoO2中のLi原子の存在比は任意性があります。実際のリチウムイオン電池では、充電時に正極はLiCo02がLi1-xCo02に変化し、負極はLixC6に変化します。
このとき0<x<1ですが、このときのリチウムイオン二次電池の充電時における正極・負極の変化を表すイオン反応式は次の様になります。
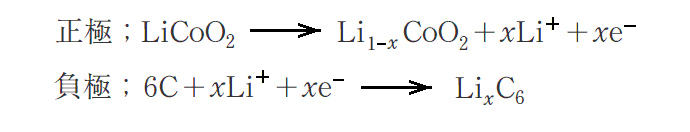
正極材の酸化コバルトがこのように、元々Liを含んでいることは、リチウムイオン二次電池を構成する正極剤として本質的に重要なことであったようです。
3.参考文献
この稿を作るに当たって、下記文献を参考にしました。感謝!
- Z会 化学 実践演習 10-1 V
- 吉野彰著「炭素材料が電池負極になるまで」炭素 TANSO, No,186. p45~49. 1999年
https://www.jstage.jst.go.jp/article/tanso1949/1999/186/1999_186_45/_pdf
- 吉野彰、他4名共著「リチウムイオン二次電池の開発と最近の技術動向」日本化学会誌, No.8, p523~534, 2000年
https://www.asahi-kasei.com/jp/asahikasei-brands/interview/yoshino/profile/pdf/trend_lithium.pdf
- 吉野彰著「リチウムイオン電池総論」ぶんせき, 10, 2013年
https://www.jsac.or.jp/bunseki/pdf/bunseki2013/201310tokusyu2.pdf
- 国際科学技術財団の日本国際賞受賞業績2018年「リチウムイオン電池の開発」
https://www.japanprize.jp/data/prize/2018/j_1_achievements.pdf
- 旭化成「リチウムイオン二次電池における吉野彰博士の業績」2020年
https://www.asahi-kasei.com/jp/asahikasei-brands/interview/yoshino/profile/pdf/outlin_lithium.pdf